با توجه به نتایج حاصل از یک مطالعهی بالینی به نظر میرسد که مصرف غذایی صمغ عربی (GA)، که یک آدامس طبیعی محلول در آب به دست آمده از درخت آکاسیا است، دفاع آنتیاکسیدانی در بیماران مبتلا به کمخونی داسی شکل را بهبود میبخشد.
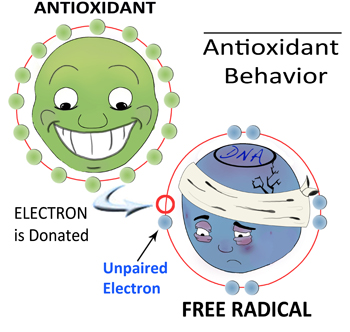
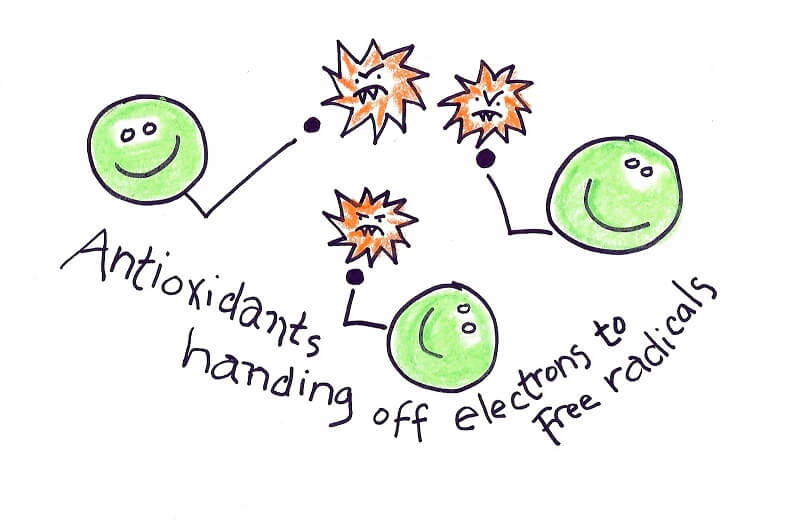
استرس اکسیداتیو عدم تعادل بین تولید عوامل مخرب ( رادیکالهای آزاد) و توانایی ما برای مبارزه با آنها به وسیلهی آنتیاکسیدانهاست. از دست دادن این تعادل ( که هموستاز نام دارد) سبب اختلال در سلولهای این بیماران میگردد که می تواند بر روی اندام های متعدد نیز تأثیر بگذارد. دادهها نشان میدهند که افزایش ظرفیت آنتیاکسیدانی سلولها ممکن است نتایج بالینی بیماران کم خونی داسی شکل را بهبود بخشد.
محققان توضیح دادند که GA مادهی خوراکی، خشک شده و ترشحات چسبندهی به دست آمده از درخت آکاسیای سنگال میتواند به عنوان عامل حفاظتی سلولی و کبدی، سمیت کلیوی و قلبی در موشهای صحرایی عمل کند. آنها فرض کردند که مصرف مرتب GA به نفع بیماران خواهد بود. برای آزمون این فرضیه، محققان یک آزمایش بالینی به منظور بررسی اثر مصرف خوراکی GA و ظرفیت آنتیاکسیدان بیماران طراحی کردند.
در مجموع، برای این مطالعه از 47 سودانی (5-42سال) مبتلا به کم خونی داسی شکل بهره گرفتند. آنها 30 گرم از GA در روز ، به مدت 12 هفته دریافت کردند. در پایان این دوره، محققان نمونهی خون از همه شرکتکنندگان جمعآوری کردند و به ارزیابی ظرفیت آنتی اکسیدانی بیماران پرداختند. موقع اندازهگیری، سطوحی از دو نشانگر خاص استرس اکسیداتیو، مالون دی آلدهید (MDA) و هیدروژن پراکسید (H2O2)، قبل و بعد از مصرف GA به دست آمد. تجزیه و تحلیل دادهها نشان داد که GA به طور قابل توجهی دفاع آنتی اکسیدانی بیماران را با افزایش سطوحی از مواد کلیدی در سیستم آنتیاکسیدان، مانند آنزیم ها (پروتئین های خاص) سوپراکسید دیسموتاز (SOD)، کاتالاز و گلوتاتیون افزایش میدهد.
علاوه بر این، GA سبب کاهش سطوح دو نشانگر اکسیداتیو MDA و H2O2 میشود، یک فنوتیپ نیز زمانی که GA در مطالعه قبلی در یک مدل حیوانی نارسایی مزمن کلیه CRF(برای ارزیابی MDA ) مورد آزمایش قرار گرفت، مشاهده شده است. این یافته ها نشان داد که GA دارای اثرات محافظتی در برابر استرس اکسیداتیو و آسیب بافتی در این بیماران است. دانشمندان بر این باورند که این تحقیق اولین مطالعهای است که اثرات آنتی اکسیدان قوی GA در انسان را نشان میدهد.
محققان به این نتیجه رسیدند که : “افزایش مصرف آنتی اکسیدان ها در رژیم غذایی از GA ممکن است به حفظ وضعیت دفاع آنتی اکسیدانی کافی و در نتیجه مدیریت بیماری کم خونی داسی شکل کمک کند. ”
منبع :