کاهش سطح آنتیاکسیدانی در روده بزرگ ممکن است بر التهاب گوارشی ( GI ) تاثیر مثبت داشته باشد. مطالعه جدید نشان میدهد کاهش سطح آنتیاکسیدانی در روده بزرگ اثرات غیر منتظره مثبتی بر التهاب گوارشی دارد.
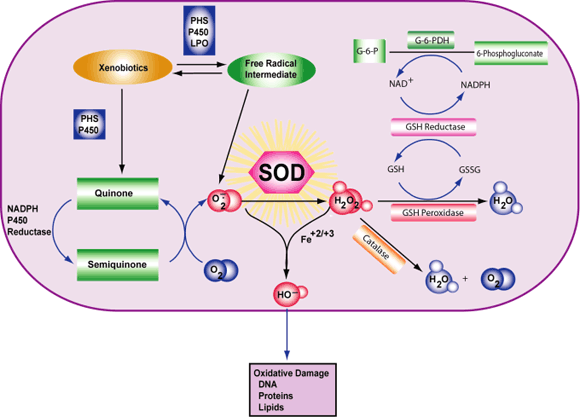
آنتیاکسیدانها به طور کلی به عنوان مواد مفید بدن شناخته شدهاند که به مبارزه با بیماری و مرگ سلول کمک میکنند. بدن انسان با تولید گلوتاتیون احیاشده (GSH)و آنتیاکسیدانها به عملکرد سیستم عصبی مرکزی و محیطی تاثیر میگذارند. GSH همچنین سلولهای عصبی (نورونها) را در سیستم عصبی عضلانی زنده نگه میدارد؛ شبکهای که عملکرد دستگاه گوارش را کنترل میکند. تحقیقات قبلی نشان داده است که نورونهای روده قادر به تولید GSH هستند و کمبود GSH باعث آسیب سلولی (استرس اکسیداتیو) و مرگ نورون میشود.
محققان دانشگاه ایالتی میشیگان اثرات کاهش GSH در موشهای مبتلا به التهاب کولون به عنوان یک مدل بیماری التهابی روده بررسی کردند. یک گروه از موشها به نحوی تیمار شدند که سطح GSH را در دستگاه گوارش کاهش میداد ( ورم مخاط روده تیمار شده). گروه دوم ( ورم مخاط روده تیمار نشده) سطح طبیعی GSH را حفظ کردند. هر دو این تیمارها قبل از بروز التهاب انجام گرفت.
گروه اول ( تیمار شده ) تحت درمان، دارای تجمع کمتر سلولهای ایمنی (نفوذ نوتروفیلی) در اطراف سلولهای GI در مقایسه با گروه دوم ( تیمار نشده ) بود. نفوذ نوتروفیل پاسخی به التهاب است؛ بنابراین نفوذ کمتر ممکن است با کاهش آسیب التهابی همراه باشد. موش های تیمار شده همچنین کاهش وزن همراه با بیماری روده را تجربه نکردهاند، که این مساله بیانگر سطح GSH کاهش یافته است. به طرز شگفت آوری محافظت کولون از التهاب شدید منجر به کاهش آسیب در این مدل میشود.
این مطالعات یک هدف بالقوه درمانی در جهت بهبود آسیبشناسی GI در طی التهاب است.
منابع:
Pavlick, K.P., Laroux, F.S., Fuseler, J., Wolf, R.E., Gray, L., Hoffman, J. and Grisham, M.B., 2002. Role of reactive metabolites of oxygen and nitrogen in inflammatory bowel disease1, 2. Free Radical Biology and Medicine, 33(3), pp.311-322.
D’Odorico, S. Bortolan, R. Cardin, R. D’Inca’, D. Martines, A. Ferronato, GC Sturniolo, A., 2001. Reduced plasma antioxidant concentrations and increased oxidative DNA damage in inflammatory bowel disease. Scandinavian journal of gastroenterology, 36(12), pp.1289-1294.
De-Souza, D.A. and Greene, L.J., 2005. Intestinal permeability and systemic infections in critically ill patients: effect of glutamine. Critical care medicine, 33(5), pp.1125-1135.