مقدمه: محققان به تازگی موفق به انتشار اطلاعاتی در مورد جنین هیبرید انسان ـ خوک شدند که به نوبه خود می تواند گام موثری در پرورش حیوانات با ارگانهای داخلی انسانی بوده و برای پیوند عضو بسیار کاربردی باشد.
گروه محققان بر طبق گزارشی منتشر شده در مجله Cell در سال 2016 کایمراهای هیبرید موش آزمایشگاهی- موش صحرائی و انسانی- گاوی را گزارش نمودند. این حیوانات علاوه بر مورد فوق به عنوان مدل های آزمایشگاهی در تحقیقات بر روی داروها و مراحل ابتدایی تکوین انسان نیز مثمر ثمر بوده اند.
برای خلق کایمراها پژوهشگران سلولهای بنیادی پرتوان را که قابلیت تولید هرگونه بافتی را دارند از یک گونه به جنین گونه دوم که در مراحل بسیار ابتدایی به سر می برد تزریق می کنند. از لحاظ تئوری سلولهای خارجی باید در تمام بدن تکثیر و تمایز یابند اما در حالت آزمایشگاهی تولید هیبریدهای جنین بسیار مشکل است.
جهت فائق آمدن بر مشکل مذکور پژوهشگران از تکنولوژی ویرایش ژن بنام CRISPR استفاده نمودند تا بتوانند جنین موش آزمایشگاهی تولید کنند که فاقد ژنهای کد کننده اندام باشند. دانشمندان پس از این مرحله سلولهای بنیادی موش صحرائی را به جنینهای موش آزمایشگاهی تزریق و پس از آن جنینها را به رحم موش آزمایشگاهی انتقال دادند.
بدلیل اینکه سلولهای موش صحرائی همچنان حاوی ژنهای القاءکننده شکلگیری بافتها بودند، کایمرای بوجود آمده دارای ارگانهایی بود که تعداد کثیری از سلولهای موش صحرائی را با خود به همراه داشتند. حیوان حاصل از این آزمایش به مدت ۲ سال زندگی کرد که کاملا مطابق با متوسط طول عمر یک موش آزمایشگاهی بود.
ترکیب و تطابق
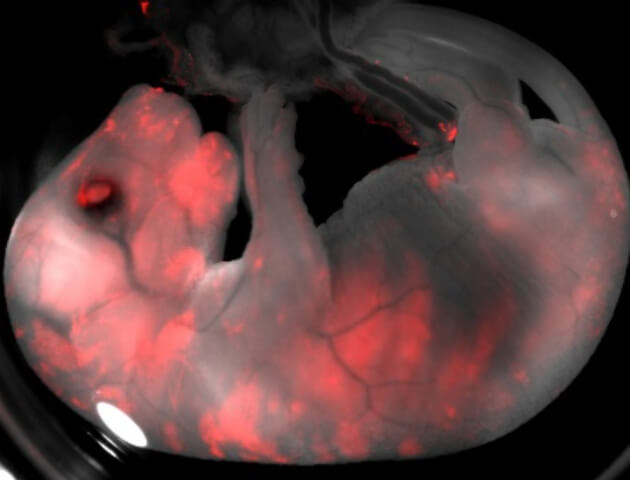
در مرحله بعدی دانشمندان تصمیم گرفتند دو گونهای که دور از هم میباشند را برای هیبریدیزاسیون مورد هدف قرار دهند که درنهایت بر روی مطالعه انسان و خوک به تفاهم رسیدند. گروه محققان به ۱۴۰۰ جنین خوک، یکی از سه نوع سلولهای انسانی که شامل سلولهای انسانی نرمال، سلولهای بنیادی پرتوان و سلولهایی که انتظار می رفت به بافتها تمایز یابند(سلولهای میانرده) تزریق نمودند . در این مطالعه برای اینکه سلولهای انسانی قابلیت تشخیص را داشته باشند محققان آنها را جهت اتساع رنگ فلورسنت دستکاری کردند.
پس از مرحله فوق در بهترین شرایط فقط ۱ سلول از هر ۱۰۰۰۰۰ سلول در کایمرا متعلق به انسان بود. یکی از محققان در این مورد گفت: اکنون تمام پژوهشگران می توانند وجود سلول انسانی در خوک را دریابند و مشاهده کنند که یک سلول در خوک دارای ژنوم طبیعی یک انسان است. با این حال عده ای دیگر بر این اعتقادند که تعداد کم سلولهای انسانی در کایمرای انسانی- خوکی مبین یک نتیجه منفی در این راستاست و با این حال فاصله زیادی از کایمراها تا اهدا عضو به انسان وجود دارد.
امید به پیوند
گروه دیگری از محققان راهکار مشابهی را برای کایمرای انسان- گوسفند آزمایش می کند، و تصور آنها بر این است که جنین گوسفند می تواند توانایی بیشتری نسبت به جنین خوک در نگهداری سلولهای انسانی داشته باشد. اما، به گفته یکی از اعضای این گروه به احتمال زیاد خوک بهترین گزینه برای اهدا عضو خواهد بود به این دلیل که طول زمان زایمان خوک منجر به رشد سریع ارگانها می شود، همچنی ارگانهای خوک از لحاظ اندازه بسیار شبیه به ارگانهای انسان می باشد.
محققان روش های بسیاری را برای تبدیل خوک به بک اهدا کننده عضو انسانها مد نظر قرار دادهاند که یکی از آنها استفاده از CRISPR برای عدم فعالیت پروتئینهای خوک است که میتواند منجر به پاسخ ایمنی در پریماتها شود. با وجود کایمرا پزشکان میتوانند برای بیماران نیازمند اهدا عضو با اخذ سلول از خود فرد و تولید عضو توسط کایمرا، ارگان مد نظر را که حاوی سلولهای خود فرد است به وی منتقل کنند.
منبع:
Jun Wu, Aida Platero-Luengo, Masahiro Sakurai, Atsushi Sugawara, Maria Antonia Gil, Takayoshi Yamauchi, Keiichiro Suzuki, Yanina Soledad Bogliotti, Cristina Cuello, Mariana Morales Valencia, Daiji Okumura, Jingping Luo, Marcela Vilariño, Inmaculada Parrilla, Delia Alba Soto, Cristina A. Martinez, Tomoaki Hishida, Sonia Sánchez-Bautista, M. Llanos Martinez-Martinez, Huili Wang, Alicia Nohalez, Emi Aizawa, Paloma Martinez-Redondo, Alejandro Ocampo, Pradeep Reddy, Jordi Roca, Elizabeth A. Maga, Concepcion Rodriguez Esteban, W. Travis Berggren, Estrella Nuñez Delicado, Jeronimo Lajara, Isabel Guillen, Pedro Guillen, Josep M. Campistol, Emilio A. Martinez, Pablo Juan Ross, Juan Carlos Izpisua Belmonte, Interspecies Chimerism with Mammalian Pluripotent Stem Cells, Cell, Volume 168, Issue 3, 26 January 2017, Pages 473-486.e15