مطالعات جدید نشان میدهد که چگونه یک باکتری غالب پوست انسان، آنزیمی با خواص آنتی اکسیدانتی ترشح میکند که نه تنها به بقای آن میکروارگانیسم کمک می کند، بلکه ما را در مقابل بیماریها و آسیبها محافظت مینماید.
P. acnes یكی از هزاران نوع باكتری است كه بر روی بدن انسان همزیستی میكند. در این جمعیت تعداد سلولهای باكتریایی بیشتر از تعداد سلول های انسان بوده و نسبت ١٠ به ١ را دارند. پر واضح است كه نیاز ما به باكتریها برای سلامتی، بیشتر از نیاز انها به ما به عنوان محیط رشد میباشد. باكتریها ویتامین تولید میکنند كه در بدن انسان ژن تولید آن وجود ندارد. همچنین باكتریها غذا را به اجزای كوچك تر تبدیل میكنند بنابر این میتوانیم مواد مورد نیاز خود را برای بقا و زندگی از این اجزا استخراج نماییم. باكتریها سیستم ایمنی انسان را جهت تشخیص پاتوژن های خطرناك و همچنین تولید مواد ضد التهابی آموزش میدهند.
ترشح آنزیمی كه ویژگیهای آنتی اكسیدانتی قوی دارد
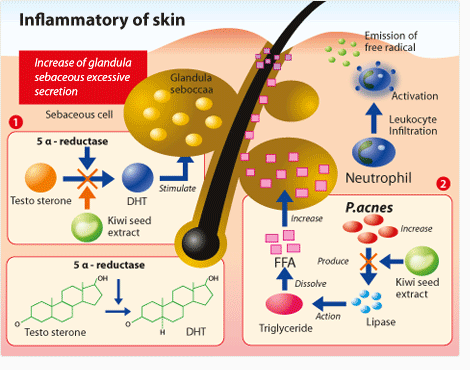
در این مطالعه بیان شده است كه باكتری P. acnes با ترشح أنزیمی به نام Rox P در شرایط اكسیداتیو از سلول در برابر اسیبها و تخریب های احتمالی محافظت می نماید. بنا به آزمایشات گوناگون كه شامل تست بر روی پوست انسان نیز میباشد دانشمندان دریافتند كه آنزیم Rox P هم قادر به كاهش رادیكالهای آزاد و هم قادر به مراقبت از مولكول ها در مقابل اكسیداسیون میباشد. با توجه به آخرین یافتهها این آنزیم اولین انزیم شناخته شده با فعالیت آنتی اكسیدانتی است. معمولترین مثال برای آسیب استرس اكسیداتیو، آسیب به وجود آمده در سطح پوستی است كه در معرض اشعهی ماوراء بنفش نور خورشید قرار گرفته است. تصور بر این است كه استرس اكسیداتیو در ایجاد بیماریهای مزمن پوستی از جمله پسوریازیس، آتوپیك درماتیك و سرطان پوست موثر است. خواص آنتی اكسیدانتی آنزیم Rox P بیشتر از آن دسته موادی است كه پیشتر به عنوان آنتی اكسیدانت شناخته میشدند مانند ویتامین های E و C.
P. acnes از معمول ترین باكتریهای سطح پوست است كه هم در سطح پوست سالم و هم در سطح پوست بیمار یافت می شود. بر اساس توضیحات دكتر لود همان طور كه سطح این باكتری بر روی پوست افراد مختلف متفاوت است سطح محافظتی این آنزیم نیز می تواند متغیر باشد.
Rox P می تواند به درمان بیماریهای پوستی كمك كند
مطالعات تیم تحقیقاتی نشان میدهد كه ترشح یك آنتی اكسیدانت منحصربفرد از باكتری P. acnes نه تنها از سلول ها در برابر استرس اكسیداتیو محافظت می كند بلكه به حفظ شرایط مورد نیاز پوست سالم كمك میكند. تحقیقات تیم مذكور بر روی پوست انسان و حیوان متمركز شده است. در تحقیقات حیوانی تاثیر یا عدم تاثیر خواص محافظتی انزیم بررسی و همچنین اثر اشعه ی ماوراء بنفش بر روی پوست موشهای تیمار شده با Rox P و تیمار نشده مقایسه خواهد شد. پیشنهادات دكتر لود حاكی از آنست که اگر نتایج تحقیقات پیش رو مثبت باشد میتوانند اجازهی استفاده از Rox P در كرم های ضد آفتاب و درمان بیماریهای پوستی از جمله پسوریازیس و آتوپیك درماتیك را صادر نمایند.
منبع: