مطالعات اخیر نشان میدهد که فلور میکروبی روده باعث تنظیم متابولیسم آنتیاکسیدانت گلوتاتیون و آمینو اسید در میزبان میشود. گلوتاتیون یک آنتیاکسیدانت کلیدی است که در تمامی سلولهای بدن یافت میشود. کمبود گلوتاتیون باعث استرس اکسیداتیو میشود که نقش مهمی در بسیاری از بیماریهای مرتبط با سبک زندگی دارد.
خروجی عملکردی و تنوع فلور میکروبی روده تنظیمکنندگان مهمی در بروز بیماریهای مختلف انسان هستند. چاقی، دیابت نوع ۲، آترواسکلروز، کبد چرب غیر الکی و سوء تغذیه از جمله این بیماریها هستند. بنابراین واکنش بین فلور میکروبی روده، بافت روده میزبان و سایر بافتهای بدن با سلامت میزبان بسیار مرتبطند.
در مقالهای که در نشریه Molecular Systems Biology توسط تیمی از دانشگاههای صنعتی چالمرز، انستیتو سلطنتی تکنولوژی و دانشگاه گوتنبرگ سوئد چاپ شده، عنوان شده است که فلور میکروبی روده باعث تنظیم متابولیسم گلوتاتیون و آمینو اسید در میزبان میشود.
گلوتاتیون قویترین آنتیاکسیدانت بدن و اصلیترین ماده سمزدای (Detoxifying agent) بدن است. این ماده در سیستم ایمنی بدن، متابولیسم مواد غذایی و تنظیم سایر رخدادهای سلولی، نقش بسیار حیاتی دارد. گلوتاتیون پروتئین کوچکی است و در داخل سلول از ۳ آمینو اسید که بطور مداوم از طریق تغذیه وارد بدن میشوند، ساخته میشود. کمبود گلوتاتیون باعث بروز استرس اکسیداتیو میشود. همانطور که اشاره شد، استرس اکسیداتیو نقش بسیار مهمی در بیماریهای متابولیک دارد.
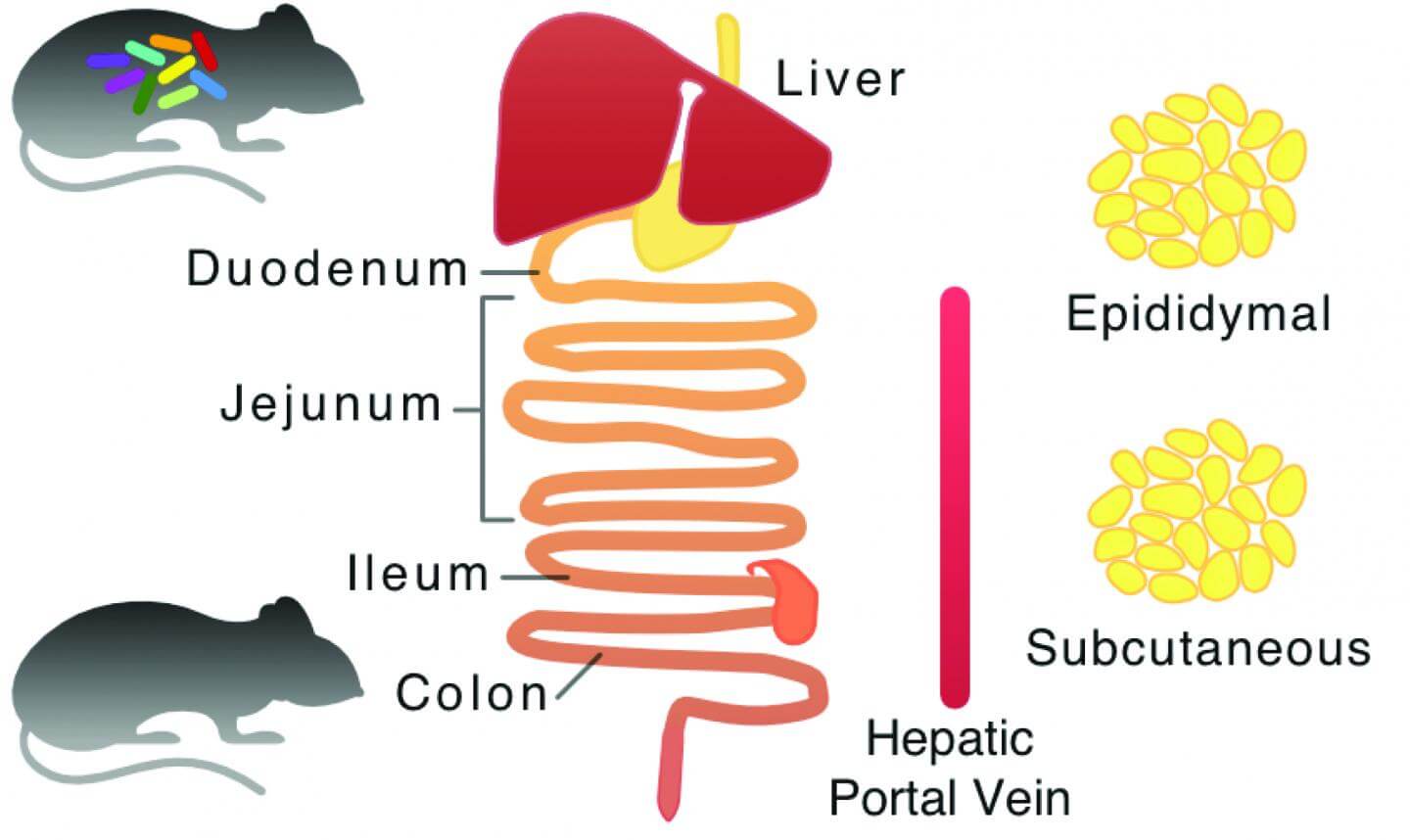
در این مطالعه، نقشهای کلی از متابولیسم موش طراحی شد و مدلهای رایانهای ویژهای برای هر بافت ایجاد گردید. بهوسیله استفاده از دادههای تجربی High throughput، محققین دریافتند که فلور میکروبی در روده گلایسین مصرف میکند. گلایسین یکی از ۳ آمینو اسیدی است که برای ساخت گلوتاتیون در بدن مورد نیاز است.
برای تایید نتایج بهدست آمده از طریق شبیهسازیهای مبتنی بر رایانه، سطوح آمینو اسید گلایسین در ورید پرتال کبدی موش اندازیگیری شد. علاوهبراین سطوح پایینتری از گلایسین در بافت کبد و کولون یافت شد که نشانگر تنظیم متابولیسم گلوتاتیون نه تنها در روده کوچک، بلکه در کبد و کولون توسط فلور میکروبی روده است.
عادل ماردین اولو نویسنده مسئول این مقاله از دانشگاه چالمرز میگوید:”برخی از باکتریهای روده گلایسین مصرف میکنند و عدم وجود تعادل در ترکیب باکتریهای روده باعث ایجاد بیماریهای مزمن میشود” در مطالعات مستقل قبلی نیز سطوح نامتعادل گلایسین و سایر آمینو اسیدهای پلاسما در بیماریهای چاقی، دیابت نوع ۲ و کبد چرب غیر الکلی گزارش شده است.
این اکتشاف ممکن است به توسعه محصولات غذایی منجر شود که باکتریهای مفید (پروبیوتیکها) را به بدن انتقال دهند. نتایج این مطالعه به ما کمک میکند تا نقش باکتریها در ایجاد و توسعه بیماریهای متابولیکی چون دیابت نوع ۲، چاقی، کبد چرب غیر الکلی و سوء تغذیه چگونه است.
منبع:
Mardinoglu, A., Shoaie, S., Bergentall, M., Ghaffari, P., Zhang, C., Larsson, E., Bäckhed, F. and Nielsen, J., 2015. The gut microbiota modulates host amino acid and glutathione metabolism in mice. Molecular systems biology, 11(10), p.834.