تیموس عضو بسیار حیاتی در بدن است که با گذر عمر پیر و چروکیده میشود و افراد پیر را در معرض خطر ابتلای بیشتری به عفونتهای کشنده قرار میدهد. مقاله چاپ شده در مجله Cell Reports عنوان میکند که آتروفی تیموس ممکن است با عدم توان آن در حفاظت تخریب DNA در مقابل رادیکالهای آزاد مرتبط باشد. این آسیب با تسریع اختلال عملکردی متابولیک در تیموس بصورت پیشرونده باعث کاهش تولید سلولهای T مقابلهکننده با پاتوژن میشود.
با وجو اینکه پیشتر عنوان شده است که آنتیاکسیدانتها جلوی پیری را نمیگیرند، این یافتهها نشان میدهد آنتیاکسیدانتهای خوراکی معمول ممکن است باعث کاهش آتروفی تیموس شده و میتواند به عنوان یک درمان پیشگیرانه و محافظتی افراد مسن در مقابل عفونت در نظر گرفته شود.
هووارد پتری نویسنده مسئول این مقاله میگوید:«تیموس نسبت به سایر اعضای بدن سریعتر دچار پیری میشود و این امر باعث کاهش توانایی افراد در تقابل با چالشهای جدید ایمونولوژیک میشود. ما برای اولین بار یک حلقه مکانیکی بین آنتیاکسیدانتها و عملکرد طبیعی ایمنی بدن تعیین کردهایم که راهکارهای جدیدی برای استراتژیهای جدید درمان ارائه میکند تا سیستم ایمنی در جامعه مسن بهبود یابد.»
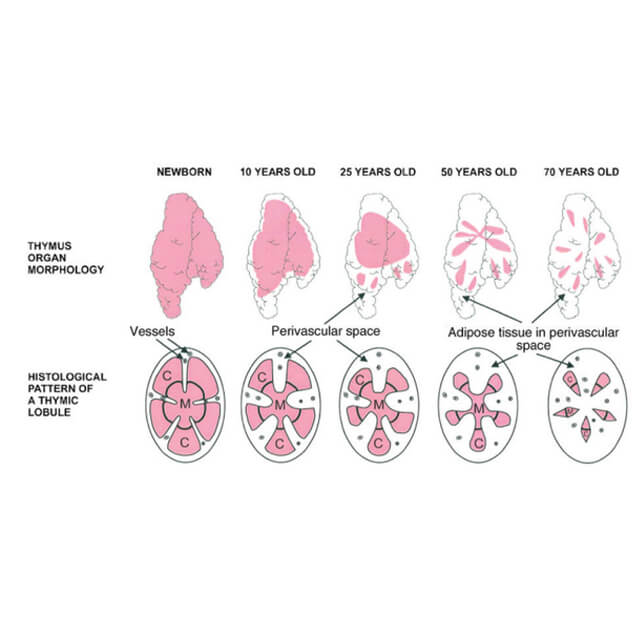
تیموس سلولهای ایمنی T را که بسیار حیاتی هستند را تولید میکند. این سلولهای بصورت مداوم میمیرند و نیاز به جایگزینی مداوم دارند. اما با رسیدن سن بلوغ، تیموس کوچک شده و قابلیت تولید سلولهای جدید و بهمقدار کافی را از دست میدهد. این نقص تا حدودی با تقسیم سلولهای T موجود جبران میشود اما سلولهای حاصل بیشتر بهسمت سلولهای خاطره تمایل پیدا میکنند که بر اساس عفونتهای پیشین یا حال حاضر در بدن پاتوژنهای را تشخیص میدهند. در نتیجه ایمنی طیف گسترده در مقابل پاتوژنهای حدید و ایمنی محافظتی حاصل از واکسنهای جدید با گذر عمر کاهش پیدا میکند.
این تیم تحقیقاتی طی مطالعات خود دریافتند که سلولهای استرومایی دچار کمبود آنزیم آنتیاکسیدانتی به نام کاتالاز هستند که این امر باعث تجمع رادیکالهای آزاد در این ارگان و صدمه متابولیک میشود.
برای بررسی اثر عدم وجود کاتالاز بر آتروفی تیموس محققین آزمونهای ژنتیکی اجرا کردند که سطوح کاتالاز را در تیموس موش بهدست آورند. در سن شش ماهگی، اندازه تیموس موشهای مهندسی ژنتیک شده دو برابر اندازه آن در موشهای معمولی بود. علاوه بر این، موشهای درمان شده با ۲ آنتیاکسیدانت معمول از زمان از شیر گرفتگی، در ۱۰ هفتگی اندازه تیموس تقریبا نرمالی را داشتند.
بهطور کلی، یافتههای این پژوهش، نظریه رادیکالهای آزاد و پیری را قوت بخشید، بدین صورت که گونههای فعال اکسیژن از جمله پراکسید هیدروژن باعث آسیب سلولی شده و نهایتا منجر به پیری و انواع بیماریهای وابسته به سن میشوند. فرآیندهای پیری در تیموس بصورت پیشرونده اما آهسته شکل گرفته و تا اواخر عمر آشکار نمیشوند. مولکولهای سمی، به عنوان یک محصول طبیعی فرعی که از متابولیسم اکسیژن در سلول تولید میشوند، با آتروفی پیشرونده در بسیاری از اندامها و بافتها به عنوان بخشی از روند طبیعی پیری در ارتباط هستند.
پتری همچنین میافزاید: «در مورد تیموس، آتروفی بسیار سریعتر از سایر بافتها رخ میدهد، آنچه نتایج ما نشان میدهد، کمبود کاتالاز استرومایی ناشی از نیاز شدید متابولیک است که در جهت تامین محیط مناسب برای تکثیر سلولهای T طراحی شده است. مطالعات ما همچنین اثبات کرده است که آتروفی تیموس، فارغ از یک رابطه ویژه با استروئیدهای جنسی، نشاندهنده روند آسیب سلولی تجمعی ناشی از قرار گرفتن طولانیمدت در معرض فرآوردههای فرعی اکسیداتیو تولیدی طی متابولیسم هوازی است.»
در مطالعات آتی، محققان به بررسی اثر مصرف مکملهای آنتیاکسیدانتی در دوران پیری بر عملکرد غده تیموس و سیستم ایمنی خواهند پرداخت. در صورتی که این مطالعات، فرضیه فوق را به اثبات برساند، آنها میتوانند راهکارهای جدید بالینی برای پیشگیری یا درمان آتروفی مرتبط با سن تیموس در انسان ارائه دهند.
منبع:
Griffith AV, Venables T, Shi J, Farr A, Van Remmen H, Szweda L, Fallahi M, Rabinovitch P, Petrie HT. Metabolic damage and premature thymus aging caused by stromal catalase deficiency. Cell reports. 2015 Aug 18;12(7):1071-9.